Confira a diferença entre moléculas polares e apolares
*A capacidade que as ligações possuem de atrair cargas elétricas se define como Polaridade, esta assume caráter diferente dependendo da ligação onde se faz presente.
As ligações mais frequentes envolvendo compostos orgânicos acontecem entre átomos de carbono ou entre átomos de carbono e hidrogênio: C ─ C e C ─ H (hidrocarbonetos). Classificamos este tipo de ligação como covalente, ela está presente em todas as ligações dos compostos orgânicos formados somente por carbono e hidrogênio.
Quando na molécula de um composto orgânico houver outro elemento químico além de carbono e hidrogênio, suas moléculas passarão a apresentar certa polaridade. Chamamos este elemento de heteroátomo e pode ser: nitrogênio (N), oxigênio (O), entre outros.


Metano (CH4) Etano (C2H6)
Repare que em ambas as estruturas não há presença de heteroátomos, neste caso as moléculas se classificam como apolares.

As ligações mais frequentes envolvendo compostos orgânicos acontecem entre átomos de carbono ou entre átomos de carbono e hidrogênio: C ─ C e C ─ H (hidrocarbonetos). Classificamos este tipo de ligação como covalente, ela está presente em todas as ligações dos compostos orgânicos formados somente por carbono e hidrogênio.
Quando na molécula de um composto orgânico houver outro elemento químico além de carbono e hidrogênio, suas moléculas passarão a apresentar certa polaridade. Chamamos este elemento de heteroátomo e pode ser: nitrogênio (N), oxigênio (O), entre outros.


Metano (CH4) Etano (C2H6)
Repare que em ambas as estruturas não há presença de heteroátomos, neste caso as moléculas se classificam como apolares.


A presença do Oxigênio como heteroátomo faz as moléculas apresentarem polaridade. A primeira molécula se trata do composto Etanol (CH3CH2OH), a presença da hidroxila – OH dá a este composto o caráter polar, mesmo que em sua estrutura contenha uma parte apolar.
Por Líria Alves
Graduada em Química
Equipe Brasil Escola
Graduada em Química
Equipe Brasil Escola
* É fácil notar, numa festa ou num ambiente de trabalho, que não somos totalmente iguais aos outros. Mas, se deixarmos de procurar somente as diferenças, a festa ficará menos estranha, e o trabalho, mais solidário.
Na química, observa-se uma generalização: a tendência de as substâncias semelhantes dissolverem as semelhantes.
As moléculas da água (H2O) são diferentes das do álcool comum (C2H5OH), mas, por serem semelhantes quanto à polaridade, formam misturas homogêneas. Através da forma geométrica das moléculas e utilizando vetores, é possível saber se elas são polares ou apolares.
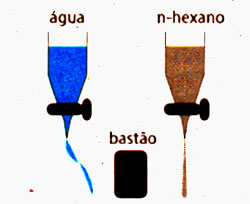
Experimentalmente também é. Isso foi tema de uma questão da Unicamp/2001, que pedia ao candidato que considerasse duas buretas lado a lado. Numa se colocava água e na outra n-hexano. Utilizando um bastão de plástico atritado em uma flanela e abrindo as torneiras, os líquidos escorriam formando fios. Posicionando o bastão entre os fios, indagava-se se era possível identificar qual das duas buretas continha o n-hexano. Sim, era. Veja:
Como as moléculas de água são polares e as de n-hexano são apolares, a aproximação do bastão eletricamente carregado causa desvio apenas no fio de água.
Veja uma questão da Fuvest/ 2001: "Azeite e vinagre, quando misturados, separam-se logo em duas camadas. Porém, adicionando-se gema de ovo e agitando-se a mistura, obtém-se a maionese, que é uma dispersão coloidal. Nesse caso, qual foi o papel representado pela gema de ovo?".
O vinagre (ácido acético) é uma substância polar, e o óleo, apolar, com tendência de não se misturarem. Mas a gema age como um emulsificador, estabilizando a mistura coloidal.
De forma diferente, o sabão e o detergente, por possuírem em suas estruturas uma extremidade polar e outra apolar, agem como uma ponte entre a água (polar) e o óleo (apolar), possibilitando, por exemplo, a remoção da oleosidade de uma panela.
Na química, observa-se uma generalização: a tendência de as substâncias semelhantes dissolverem as semelhantes.
As moléculas da água (H2O) são diferentes das do álcool comum (C2H5OH), mas, por serem semelhantes quanto à polaridade, formam misturas homogêneas. Através da forma geométrica das moléculas e utilizando vetores, é possível saber se elas são polares ou apolares.
Experimentalmente também é. Isso foi tema de uma questão da Unicamp/2001, que pedia ao candidato que considerasse duas buretas lado a lado. Numa se colocava água e na outra n-hexano. Utilizando um bastão de plástico atritado em uma flanela e abrindo as torneiras, os líquidos escorriam formando fios. Posicionando o bastão entre os fios, indagava-se se era possível identificar qual das duas buretas continha o n-hexano. Sim, era. Veja:
 | |
Como as moléculas de água são polares e as de n-hexano são apolares, a aproximação do bastão eletricamente carregado causa desvio apenas no fio de água.
Veja uma questão da Fuvest/ 2001: "Azeite e vinagre, quando misturados, separam-se logo em duas camadas. Porém, adicionando-se gema de ovo e agitando-se a mistura, obtém-se a maionese, que é uma dispersão coloidal. Nesse caso, qual foi o papel representado pela gema de ovo?".
O vinagre (ácido acético) é uma substância polar, e o óleo, apolar, com tendência de não se misturarem. Mas a gema age como um emulsificador, estabilizando a mistura coloidal.
De forma diferente, o sabão e o detergente, por possuírem em suas estruturas uma extremidade polar e outra apolar, agem como uma ponte entre a água (polar) e o óleo (apolar), possibilitando, por exemplo, a remoção da oleosidade de uma panela.
*Renato Tadeu é professor e diretor do Anglo (Atibaia, Jundiaí e Bragança Paulista) e do Colégio Leonardo da Vinci
Fonte: http://vestibular.uol.com.br/ultnot/resumos/ult2767u19.jhtm



